Das Medikament Androcur, insbesondere gegen Endometriose oder zur Empfängnisverhütung verschrieben, ist mit einem erhöhten Meningeomrisiko verbunden. Eine Opfervereinigung reichte am Dienstag, dem 5. November, in Paris Klage gegen X ein.
Ein „Bankrott“ der für die Sicherheit rund um Androcur verantwortlichen Akteure. Dies prangert Amavea, ein Verband, der die Opfer dieser Droge vertritt, in einer am Dienstag, dem 5. November, in Paris eingereichten Klage gegen X an. Dieses antihormonelle Produkt wird seit Jahren gegen Akne, Haarausfall, aber auch als Verhütungsmittel oder als Lösung bei Endometriose verschrieben. Ursprünglich wurde das Medikament zur Bekämpfung von Hirsutismus, einer Haarwuchsstörung, entwickelt, berichtete AFP.
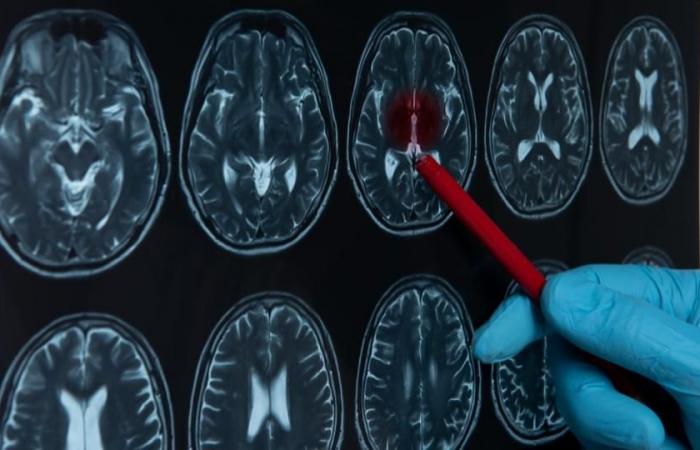
Dennoch ist Androcur für viele potenziell schwerwiegende Nebenwirkungen verantwortlich und würde das Risiko für die Entwicklung eines Meningeoms, eines Hirntumors, erhöhen. In der eingereichten Anzeige werden nach Informationen unserer Kollegen in Le Monde fünf Straftaten hervorgehoben.
Im Einzelnen prangert der Verband die Verabreichung eines gesundheitsschädlichen Stoffes, die unfreiwillige Schädigung der Integrität der Person, die Gefährdung anderer, die Unterlassung der Meldung schädlicher Wirkungen und die schwere Täuschung an.
ab 1998 gemeldete Tumorfälle
„Es ist jetzt offensichtlich, dass die für die Sicherheit von Androcur verantwortlichen Akteure – Gesundheitsbehörde, Labore, Ärzte – bei der Bewältigung der Nebenwirkungen dieses Medikaments versagt haben“, bedauern Me Charles Joseph-Oudin und Emmanuelle Mignaton, Präsidentin von Amavaea , in einer Pressemitteilung.
„Amavea, der Vertreter Tausender Opfer, möchte, dass eine Untersuchung durchgeführt wird, um die begangene Fahrlässigkeit festzustellen und die Verantwortung der beteiligten Akteure festzustellen“, fuhren sie fort und forderten die Ernennung eines Untersuchungsrichters.
Der Beschwerde zufolge „wurden seit 1998 regelmäßig Fälle von Meningeomen an Laboratorien gemeldet, die Androcur vermarkten.“
EIN RISIKO UM ZWANZIG ERHÖHT
Bereits 2007 hatten Gesundheitsexperten vor den mit diesem von Bayer vertriebenen Medikamenten verbundenen Risiken für Meningeome gewarnt. Im Jahr 2018 wurde in mehreren epidemiologischen Studien festgestellt, dass sich das Risiko bei hohen Dosen nach sechsmonatiger Behandlung um das Siebenfache erhöht. Nach fünfjähriger Behandlung erhöht sich das Risiko um das Zwanzigfache.
Für die Anwälte des Verbandes „wurde dieses Surrizid, das 2004 vom Labor identifiziert wurde, zwischen 2008 und 2009 von der Firma und der ANSM (Medicine Safety Agency) anerkannt. Vor 2019 wurden jedoch keine Informationen an verschreibende Angehörige der Gesundheitsberufe oder Patienten weitergegeben.“ . Oder jahrelanges Schweigen, so die Anwälte.
![Cette pathologie gynécologique concerne une femme sur dix en âge de procréer. [©Adobe]](https://de.dayfr.com/content/uploads/2024/11/08/e06dadf1c5.jpg)
![Cette pathologie gynécologique concerne une femme sur dix en âge de procréer. [©Adobe]](https://local.dayfr.cam/wp-content/uploads/2024/11/1731087338_252_Welches-Medikament-steht-im-Verdacht-Hirntumoren-zu-verursachen.jpg)
Erst im Jahr 2019 hätten die Gesundheitsbehörde und das Labor „einen Risikomanagementplan eingeführt, der unter anderem die Verbreitung gezielter Informationen an Patienten beinhaltete, die Androcur einnehmen“, sagten sie ebenfalls.
Frauen, die sich noch in Behandlung befinden
Von AFP kontaktiert, wollte die ANSM „in diesem Zusammenhang keinen Kommentar abgeben“.
Laut ASNM gingen die Verschreibungen von Androcur zwischen Januar 2018 und Dezember 2023 um fast 90 % zurück. Ende November 2023 waren noch weniger als 10.000 Patienten mit Androcur behandelt, Ende 2017 waren es rund 90.000 in Behandlung.
Zwischen 2009 und 2018 wurden mehr als 2.500 Frauen wegen eines Meningeoms operiert, das nach der Einnahme eines Gestagen-Medikaments entstanden war. Diese Tumoren, die die das Gehirn umgebenden Membranen befallen, sind gutartig, können aber dennoch zu erheblichen neurologischen Beeinträchtigungen führen.