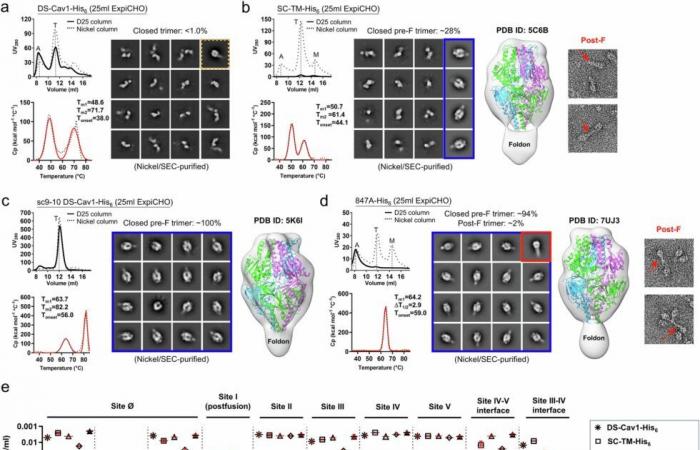
Vergleichende In-vitro-Charakterisierung zuvor beschriebener RSV-F-Designs. Kredit: Naturkommunikation (2024). DOI: 10.1038/s41467-024-54287-x
Bei den meisten Menschen lösen die lungeninfizierenden Krankheitserreger Respiratory Syncytial Virus (RSV) und Human Metapneumovirus (hMPV) leichte erkältungsähnliche Symptome aus. Doch bei Säuglingen und Senioren können diese Viren schwere Lungenentzündungen und sogar den Tod verursachen.
Es war jedoch schwierig, Impfstoffe gegen beide Viren zu entwickeln. Jetzt haben Wissenschaftler von Scripps Research die Struktur und Stabilität eines wichtigen RSV- und hMPV-Proteins analysiert, um besser darauf abzielende Impfstoffe zu entwickeln. Ihre Forschung, veröffentlicht in Naturkommunikationweist auf RSV-Impfstoffe hin, die möglicherweise wirksamer sind als bestehende, sowie auf einen Impfstoff gegen hMPV, für den es keine kommerziell erhältlichen Optionen gibt.
„Die Entwicklung eines Kombinationsimpfstoffs gegen diese Viren könnte die Anzahl viraler Krankenhauseinweisungen sowohl bei Babys als auch bei älteren Menschen erheblich reduzieren“, sagt der leitende Autor der Studie, Jiang Zhu, Ph.D., außerordentlicher Professor in der Abteilung für Integrative Struktur- und Computerbiologie bei Scripps Research. „Dies könnte die allgemeine Gesundheitsbelastung während der Grippesaison verringern, in der auch die meisten RSV- und hMPV-Fälle auftreten.“
Wissenschaftler versuchen seit langem, Impfstoffe zu entwickeln, die das Immunsystem dazu bringen, die Fusionsproteine (F) zu erkennen, die auf den Oberflächen von RSV, hMPV und verwandten Viren vorhanden sind. Diese Proteine spielen eine Schlüsselrolle dabei, dass Viren menschliche Zellen infizieren. Allerdings hat das F-Protein eine empfindliche Struktur, die sich bei der Fusion der Viren mit Zellen schnell von einer „Präfusionsform“ in eine „Postfusionsform“ verändert. Im Idealfall würde ein Impfstoff dem Immunsystem beibringen, das geschlossene F-Protein vor der Fusion zu erkennen, sodass es die Infektion stoppen kann.
„Das Problem ist, dass diese Struktur vor der Fusion so fragil und flüchtig ist“, sagt Zhu. „Wenn man die Umgebung auch nur ein kleines bisschen verändert, ist das Protein wie ein Transformator, der sich plötzlich von einem Auto in einen Roboter verwandelt.“
Dies bedeutet, dass Wissenschaftler nicht einfach ein isoliertes F-Protein vor der Fusion als Impfstoff verwenden können – seine Struktur würde sich zu schnell ändern, als dass das Immunsystem reagieren könnte. Und ein Impfstoff, der auf die Post-Fusion-Version des Proteins abzielt, würde dem Immunsystem nicht beibringen, das Virus anzugreifen, bevor es den Körper infizieren kann.
Zhu, der einen Hintergrund in der Biophysik hat und kürzlich neue Impfstoffe gegen Viren wie HIV, SARS-CoV-2 und Hepatitis C entwickelt hat, dachte, dass er den genauen Mechanismus verstehen könnte, warum das F-Protein vor der Fusion so instabil war, insbesondere Warum es so einfach zu öffnen ist, könnte er eine stabilere Form herstellen – und damit einen besseren Impfstoff.
Zhu und sein Forschungsteam analysierten zunächst die F-Proteine, die bei der Entwicklung von vier bestehenden RSV-Impfstoffen verwendet wurden – den kommerziell erhältlichen Arexvy, mResvia und Abrysvo sowie einem experimentellen Impfstoff, der Phase-3-Studien erreicht hat.
Sie entdeckten, dass einige der F-Proteine vor der Fusion instabil zu sein schienen und manchmal in eine offene Form oder, noch weniger wünschenswert, in eine Form nach der Fusion umgewandelt wurden. Eine detaillierte Strukturanalyse ergab einen „sauren Fleck“ im Zentrum der Struktur vor der Fusion mit drei positiv geladenen Molekülen, die sich gegenseitig abstoßen und bereit sind, das RSV-F-Protein bei der geringsten Störung aufzustoßen, wie ein federbelasteter Transformator.
„Das ist eine unglaubliche Eigenschaft, die sich ein Virus im Laufe der Evolution aneignen muss, um die Bewegung seines Schlüsselproteins zu kontrollieren“, sagt Zhu. „Glücklicherweise ist es auch etwas, das wir überwinden können, entweder mit roher Gewalt oder, besser noch, mit einer intelligenten Mutation, die direkt die Ursache des Problems, den sauren Fleck, bekämpft.“
Zhu hat das RSV-F-Protein umgestaltet, indem er ein Molekülpaar in seinem Zentrum verändert und so die nach außen gerichtete abstoßende Kraft in eine anziehende Kraft umgewandelt hat. Dann zeigte sein Team, dass dieses neue F-Protein im Labor stabiler war und sich erfolgreich für die Impfung von Mäusen gegen RSV eignete.
„Das deutet darauf hin, dass wir möglicherweise einen ähnlichen Ansatz für andere virale F-Proteine verfolgen können“, sagt Zhu. „Zumindest können wir bei der Entwicklung von Impfstoffen nach ähnlichen abstoßenden Stellen in ihrer Struktur suchen.“
Im hMPV-F-Protein fand Zhu nicht den gleichen Bereich abstoßender Moleküle – stattdessen nutzte er eine starke chemische Bindung als „Brute-Force“-Lösung, um das Protein zusammenzuhalten. Wieder einmal war das modifizierte Protein stabil genug, um als Impfstoff intakt zu bleiben.
In zukünftigen Studien plant Zhu die Entwicklung eines experimentellen Impfstoffs unter Verwendung einer selbstassemblierenden Protein-Nanopartikel-Plattform (SApNP), über die er in seiner jüngsten Arbeit berichtete, um die RSV- und hMPV-F-Proteine in den menschlichen Körper zu transportieren. „Das wäre unser RSV/hMPV-Kombinationsimpfstoff der nächsten Generation“, sagt Zhu.
Zu den Autoren der Studie „Rational Design of Uncleaved Prefusion-Closed Trimer Vaccines for Human Respiratory Syncytial Virus and Metapneumovirus“ gehören neben Zhu auch Yi-Zong Lee, Jerome Han, Yi-Nan Zhang, Garrett Ward, Keegan Braz Gomes, Sarah Auclair, Robyn L. Stanfield, Linling He und Ian A. Wilson von Scripps.
Weitere Informationen:
Yi-Zong Lee et al., Rationales Design von ungespaltenen Prefusion-Closed-Trimer-Impfstoffen für das humane Respiratory-Syncytial-Virus und das Metapneumovirus, Naturkommunikation (2024). DOI: 10.1038/s41467-024-54287-x
Bereitgestellt vom Scripps Research Institute
Zitat: Wissenschaftler analysieren die Struktur von Virusproteinen, um RSV-Impfstoffe voranzutreiben (2024, 19. November), abgerufen am 20. November 2024 von https://medicalxpress.com/news/2024-11-scientists-virus-protein-advance-rsv.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von einem fairen Handel zum Zweck des privaten Studiums oder der Forschung darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.